细胞周期蛋白依赖性激酶8 (CDK8) 通过与中介体复合物结合或磷酸化相关转录因子以调节转录过程,是抗炎、抗肿瘤的热门靶点。近期,公司刘新华教授团队在基于该靶点的新药设计及成药性上获得积极进展,连续在药物化学顶级期刊Journal of Medicinal Chemistry(中科院一区Top)上发表3篇研究论文,目标化合物具有成药价值。
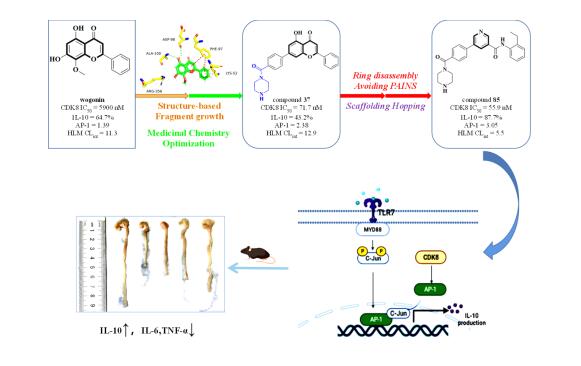
提高细胞因子IL-10的表达水平是炎症性肠病的治疗策略,由于CDK8抑制剂可以上调IL-10活化,故CDK8被认为是IBD治疗的有效靶点。研究聚焦汉黄芩素骨架,经过深入的基于结构的设计与优化,设计出新型高效的CDK8抑制剂先导化合物。该化合物能够在体内、外上调IL-10的表达;在IBD动物模型中表现出的优异的抗炎活性及较好的成药性。2022年5月10日,论文以“基于上调IL-10的新型CDK8抑制剂设计发现及其体内治疗炎症性肠病活性”长文发表在 Journal of Medicinal Chemistry, 2022, 65, 7334-7362. bat365官网登录入口2020级博士研究生闫尧瑶为第一作者,刘新华教授为通讯作者,刘明明副教授为共同通讯作者,公司为唯一作者单位,成果已专利保护。
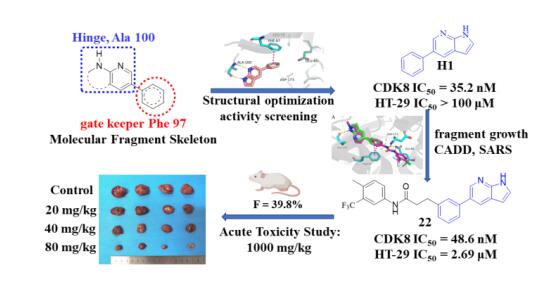
CDK8是结直肠癌的高价值靶点,多种CDK8抑制剂在体内外均显示出有效的抗结直肠癌作用,如索拉非尼,但至今尚无靶向CRC药物批准上市。研究基于从头药物设计和深入的构效关系分析,设计合成出高效的II型CDK8抑制剂,直接靶向CDK8。目标化合物低毒,生物利用度好(F=39.8%),具有较好的成药性。2022年9月7日,论文以“新型高效CDK8Ⅱ型抑制剂:1H-吡咯[2,3-b]吡啶衍生物的发现”长文发表在 Journal of Medicinal Chemistry, 2022, 65, 12095-12123. bat365官网登录入口2020级博士研究生张星新为第一作者,刘新华教授为通讯作者,石静波副教授为共同通讯作者,公司为唯一作者单位,成果已专利保护。
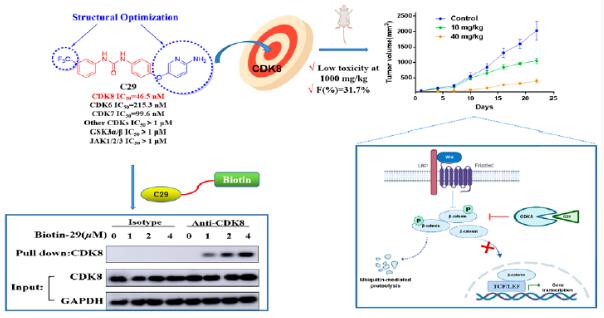
为了从另外角度探索高效CDK8抑制的设计,课题组基于索拉非尼-CDK8共晶结构及残基环境,设计合成了一系列新型的2-氨基吡啶衍生物。其中目标化合物具有优异的CDK8抑制活性,且在CDK家族内选择性良好。此外,该化合物对索拉非尼耐药HCT表现出较好的活性;低毒性和合适的药代动力学特征、较好的体内抗肿瘤活性。2022年9月20日,论文以“抗结直肠癌高效CDK8抑制剂2-氨基吡啶衍生物的设计与合成”长文发表在 Journal of Medicinal Chemistry, 2022, 65, doi.org/10.1021/acs.jmedchem.2c01042. bat365官网登录入口2020级博士研究生闫尧瑶为第一作者,刘新华教授为通讯作者,刘明明副教授为共同通讯作者,公司为唯一作者单位,成果已专利保护。(药化教研室)
